Tot ce trebuie să știe pacienții despre Aduhelm (aducanumab) | Noua medicina Alzheimer
Ultima actualizare: 15 martie 2022

Puteți accesa legal medicamente noi, chiar dacă acestea nu sunt aprobate în țara dumneavoastră.
Aflați mai multe »Articol revizuit de Dr. Jan de Witt
Pe 7 iunie 2021, FDA a aprobat aducanumab (produs sub denumirea comercială "Aduhelm") pentru tratamentul bolii Alzheimer, ridicând speranțele a milioane de pacienți cu Alzheimer și familiile lor din întreaga lume, în timp ce experții și-au exprimat îngrijorarea cu privire la această decizie.
Aduhelm este primul medicament pentru boala Alzheimer care urmează să fie aprobat de FDA în 18 ani Acest medicament susține, potrivit rezultatelor publicate, pentru a fi capabil de a încetini progresia bolii Alzheimer în sine, mai degrabă decât atenuarea simptomelor sale.
Decizia FDA de a aproba medicamentul a fost plină de controverse. Cu toate acestea, Biogen, producătorul de Aduhelm, se așteaptă să înceapă de transport maritim Aduhelm la mai mult de 900 de centre medicale din Statele Unite până la sfârșitul lunii iunie 2021.
Aduhelm este disponibil în prezent pentru pacienții potriviți în afara Statelor Unite pe o utilizare de compasiune sau o bază de pacient numit. Aflați mai multe sărind la secțiunea "Accesarea Aduhelm în afara Statelor Unite".
Boala Alzheimer: una dintre crizele sociale, medicale și economice majore ale secolului XXI
Boala Alzheimer este o tulburare degenerativă a creierului care afectează astăzi peste 40 de milioane de oameni din întreaga lume și este cea mai frecventă cauză a demenței. Considerat de mulți ani a fi o parte normală a îmbătrânirii, boala Alzheimer este acum recunoscută ca o condiție cu grave de asistență medicală, economice, și impactul social.
Cercetătorii nu înțeleg încă pe deplin ce cauzează boala Alzheimer, dar se crede că este cauzată de o combinație de factori, ar fi:
- Îmbătrânirea: Alzheimer este cel mai adesea diagnosticat după vârsta de 65 de ani (boala Alzheimer cu debut tarzie). Aproximativ o treime din persoanele în vârstă de 85 și peste au boala Alzheimer. Modificările creierului legate de îmbătrânire pot contribui la dezvoltarea afecțiunii.
- Istoricul familial: Având un membru al familiei de gradul întâi cu Alzheimer crește riscul ca o persoană să dezvolte boala. Oamenii de știință cred că o predispoziție genetică poate provoca Alzheimer cu debut precoce, care apare la persoanele cu vârsta cuprinsă între 30 și 60 de ani. Doar 10% dintre pacienții cu Alzheimer au forma cu debut precoce a bolii.
- Alți factori: Oamenii de știință au găsit legături între declinul cognitiv și bolile de inimă, precum și diabetul și obezitatea. Cele mai puternice dovezi leagă sănătatea creierului de sănătatea inimii. Leziuni ale capului au fost, de asemenea, legate de un risc crescut de Alzheimer, deoarece acestea pot declanșa formarea de plăci de amiloid. Persoanele cu sindrom Down, în care un cromozom suplimentar dictează codificarea genetică pentru un tip de proteină amiloidă legată de Alzheimer, sunt, de asemenea, expuse unui risc crescut.
Majoritatea persoanelor cu Alzheimer sunt diagnosticate în stadiul ușor, când simptomele devin mai pronunțate și boala a cauzat deja unele leziuni cerebrale, în ciuda faptului că unele simptome încep să apară chiar și cu un deceniu înainte de diagnostic. Simptomele timpurii pot fi ignorate de pacienți (adesea din cauza rușinii) sau pur și simplu nu sunt observate de medici sau membri ai familiei. Pacienții au o speranță medie de viață de 3-11 ani după diagnosticare.
"Cu timpul, mama a uitat cine sunt"
Boala Alzheimer are trei etape diferite:
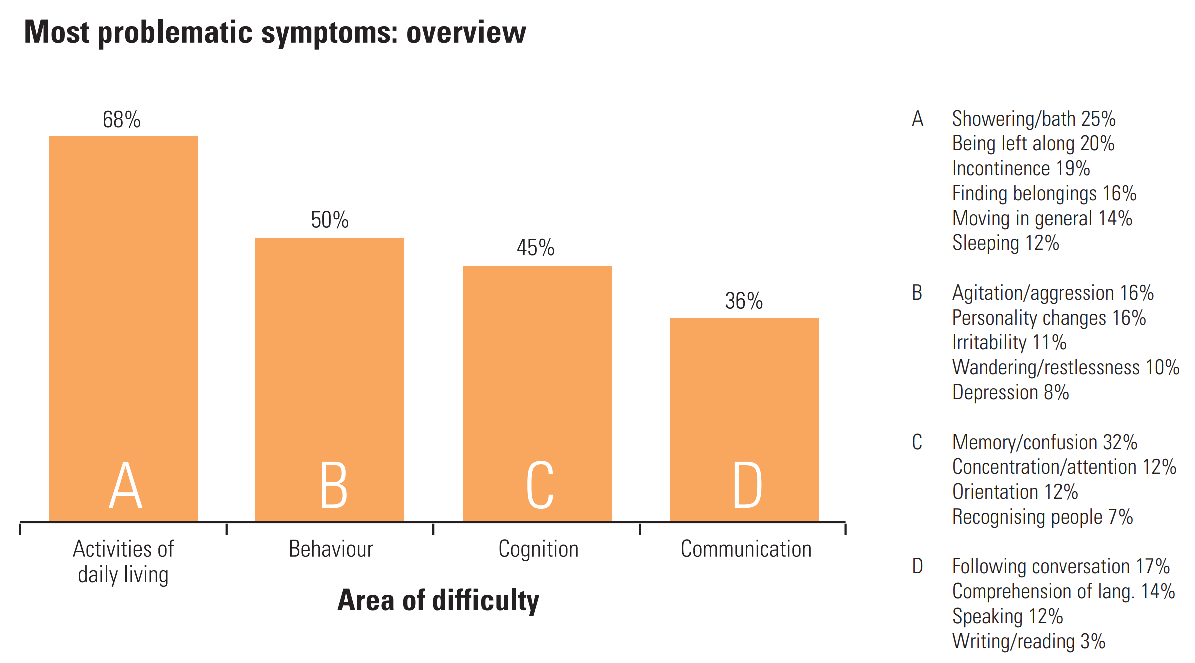
- Ușoară: În primele etape, pacienții se confruntă cu pierderi de memorie, ar fi uitarea datelor și evenimentelor importante, repetarea frecventă a întrebărilor, durează mai mult pentru a finaliza sarcinile zilnice, probleme constante cu finanțele, obiecte frecvent greșite și anxietate. (Pentru a afla mai multe despre cât de mult pierderea memoriei este normală odată cu îmbătrânirea, consultați acest infografic al Institutului Național de Sănătate (NIH) privind îmbătrânirea.)
- Moderată: Pe măsură ce boala progresează, pacienții au crescut pierderea memoriei și confuzie, dificultăți de comunicare și citire, dificultăți cu sarcinile de rutină, ar fi îmbrăcarea, probleme de recunoaștere a familiei și prietenilor, paranoia, halucinații și rătăcire.
- Severă: Pacienții cu Alzheimer sever experiență o incapacitate de a comunica, pierderea în greutate, dificultăți la înghițire, și pierderea controlului intestinului sau vezicii urinare. În acest stadiu, pacienții sunt în pat de cele mai multe ori și sunt în întregime dependenți de alții pentru îngrijirea lor.
Greutățile pacienților cu Alzheimer sunt cumplite, deoarece boala afectează fiecare aspect al vieții lor de zi cu zi. Mai jos puteți citi câteva povești ale pacienților sau ale prietenilor și familiei pacienților.
Sandy, fost dentist și profesor asistent la Harvard, a vorbit cu reporterii CNN despre realizarea sa că uitarea sa a progresat la ceva mai rău: "Mă uit la un dosar de caz dentar timp de o oră și jumătate", își amintește el. O citesc, e în creierul meu. Apoi aș închide fișierul și nu-mi amintesc literalmente nimic despre caz.'" La scurt timp după aceea, a fost diagnosticat cu boala Alzheimer.
Fred Walker, a cărui soție a fost diagnosticată cu boala Alzheimer, a vorbit cu Alzheimer's Research UK despre soția sa: "Utilizarea telefonului a devenit dincolo de capacitățile ei. Nu putea stăpâni toate butoanele. Aragazul era mult prea complex pentru a fi înțeles și exista întotdeauna pericolul ca ea să lase gazul pornit. Ea a găsit a face o ceașcă de ceai prea mult și ar obține confuz cu privire la cât de mult ceai, lapte și apă a fost nevoie.""
Boala Alzheimer, atunci când ajunge la etapele ulterioare și progresează în demență, este descris de Laury pentru Alzheimer's Society:
"[...] Ne-am îmbarcat într-o nouă călătorie. Una care implica îngrijire 24 de ore din 24, medicație zilnică, iar mama s-a pierdut complet în ceața propriei minți. [...] Nu s-a scufundat până în acel moment al serialului horror pe care l-a implicat de fapt vizionarea unei persoane dragi cu această boală crudă și insidioasă. [...] A început să aibă halucinații."
fondatorul everyone.org, Sjaak Vink, confirmă și recunoaște fiecare dintre aceste descrieri. Mama sa a fost diagnosticată cu Alzheimer în 2015.
Este un drum dificil pentru pacienți și pentru cei dragi - iar boala nu se limitează la impactul doar asupra vieții lor personale și a celor dragi.
Presiunea asupra îngrijitorilor, bugetelor și factorilor de decizie politică
Pacienții cu Alzheimer necesită îngrijire din ce în ce mai solicitantă pe măsură ce starea lor se deteriorează, ar fi îngrijirea la domiciliu, îngrijirea de noapte, serviciile de menaj sau îngrijirea medicală; în cele din urmă, pacienții ar putea avea nevoie să trăiască în centre de viață asistată sau case de îngrijire medicală. Boala are o taxă grea asupra pacientului, asupra membrilor familiei lor (care se dedică adesea îngrijirii pacientului) și asupra bugetelor lor personale și ale statului.
Îngrijitorii de familie se confruntă cu o misiune dificilă atunci când au grijă de cei dragi cu boala Alzheimer. Un studiu a constatat că 95% dintre îngrijitorii de familie din Marea Britanie spun că le-a afectat sănătatea fizică sau mentală, 69% au raportat că se simt în mod constant epuizați, 64% s-au simțit anxioși și 49% s-au simțit deprimați.
În Europa, boala Alzheimer și alte forme de demență afectează aproximativ 10 milioane de persoane, iar numărul acestora ar urma să crească la 14 milioane până în 2030. Se estimează că costul economic al demenței în Europa va crește la peste 250 de miliarde EUR până în 2030,peste 50 % din aceasta datorându-se costurilor de îngrijire informală. Există un acces inegal la îngrijire și tratament și, în special în Europa de Est, există o lipsă de sisteme de sprijin disponibile și programe sociale pentru pacienții cu Alzheimer și îngrijitorii acestora.
În Statele Unite, boala Alzheimer a intrat recent pe lista primelor 10 cauze de deces și este singura din top 10 fără leac cunoscut. Aceasta afectează 6 milioane de persoane din SUA, iar numărul se estimează că va crește la 12 milioane până în 2050. Până la sfârșitul anului 2021, costul național total al îngrijirii persoanelor care trăiesc cu Alzheimer și alte demențe ar putea ajunge la 355 miliarde USD și se estimează că va ajunge la 1,1 trilioane USD până în 2050.
Această finanțare, oricât de astronomică ar părea, este necesară pentru a oferi pacienților sprijin adecvat și, pe cât posibil, o viață demnă.
Datorită îngrijirii non-stop necesare, în special în etapele ulterioare, pacienții cu Alzheimer sunt afectați în special atunci când îngrijirea lor este inadecvată, ceea ce se întâmplă în multe țări sau comunități. Numai în Marea Britanie, zeci de mii de persoane cu demență sunt internate în camera de urgență în fiecare an din cauza infecțiilor, căderilor și deshidratării, care rezultă din îngrijirea insuficientă. Acest lucru subliniază, de asemenea, bugetele naționale de asistență medicală.
În timpul pandemiei de COVID-19, pacienții cu Alzheimer au fost grav afectați și au suferit un număr mare de decese din cauza vârstei, a altor condiții de sănătate pe termen lung și a provocărilor Alzheimer în sine (de exemplu, probleme de memorie și confuzie care îi fac pe pacienți să se lupte să urmeze orientările care previn infecțiile cu COVID-19).
Pacienții cu Alzheimer în casele de îngrijire au simțit consecințele dăunătoare în alte moduri, de asemenea. Din cauza îngrijirii insuficiente și a separării forțate de cei dragi pentru a-i proteja de COVID-19, singurătatea și izolarea care au urmat le-au deteriorat și mai mult sănătatea mentală și fizică.
Tratamente eficiente pentru boala sunt necesare, de asemenea, pentru a opri crizele de sănătate și economice de la atingerea proporțiilor severe.
Repere în cercetarea bolii Alzheimer
În 1910, Emil Kraepelin, un medic din Germania, a numit afecțiunea "boala Alzheimer" după medicul Alois Alzheimer, care a descoperit caracteristici patologice ale demenței prenile la un pacient cu pierderi profunde de memorie și agravarea schimbărilor psihologice. Cercetarea pentru tratamentele pentru boala Alzheimer a început abia la sfârșitul anilor 1980 în Statele Unite, dar s-a confruntat cu critici, deoarece medicii încă mai credeau că Alzheimer este o consecință inevitabilă a îmbătrânirii.
În Statele Unite, în 1978, Institutul Național pentru Îmbătrânire (NIA) și Asociația Alzheimer au încheiat un parteneriat cu Pfizer și au început primul studiu clinic pentru un medicament care va trata simptomele bolii Alzheimer. Medicamentul a fost aprobat în 1993: Cognex (tacrina), conform rezultatelor publicate, a îmbunătățit abilitățile cognitive la unii pacienți, dar nu a oprit agravarea bolii.
În următorul deceniu, au fost aprobate încă șase medicamente, toate pentru tratarea simptomelor cognitive ale bolii Alzheimer:
- Aricept (donepezil): pentru tratarea simptomelor legate de memorie și gândire
- Razadyne (galantamina): pentru tratarea simptomelor legate de memorie și gândire
- Exelon (rivastigmină): pentru tratarea simptomelor legate de memorie și gândire
- Namenda (memantină): pentru a îmbunătăți memoria, atenția, rațiunea, limbajul
- Namzaric (memantină + donepezil): o combinație a celor de mai sus
- Belsomra (Suvorexant): pentru tratarea insomniei la pacienții cu Alzheimer
Ultimul medicament aprobat pentru tratamentul bolii Alzheimer a fost aprobat în 2003. Timp de decenii, boala Alzheimer a fost considerată o consecință naturală a îmbătrânirii. Puține resurse au fost dedicate găsirii unui tratament, deoarece a existat o dezbatere dacă a fost o boală reală. Cu toate acestea, în ultimii 20 de ani, cercetătorii au dedicat resurse ample studierii bolii și dezvoltării unui tratament.
Lipsa de tratamente pentru Alzheimer nu se datorează neglijării din partea companiilor farmaceutice - industria în general a investit miliarde în cercetare. Numai compania Eli Lilly a cheltuit 4,2 miliarde de dolari în trei decenii încercând să dezvolte un medicament de succes, iar Institutul Național de Sănătate al Statelor Unite (NIH) a cheltuit mai mult de 500 de milioane de dolari pe an în cercetarea și dezvoltarea tratamentelor.
Din 2013, Congresul Statelor Unite a triplat bugetul anual al NIH pentru finanțarea cercetării Alzheimer și a demențelor conexe, ajungând la 3,1 miliarde de dolari în 2019.
Finanțarea națională și privată a dus la 2173 de studii clinice care au fost efectuate până în 2019 pentru a testa diverse teorii. Cele mai bune teorii testate:
- 19% dintre studii s-au concentrat pe o ipoteză neurotransmițătoare
- 17,0% dintre studii au testat o ipoteză în cascadă mitocondrială și alte ipoteze conexe
- 12,7% au testat ipoteza propagării tau
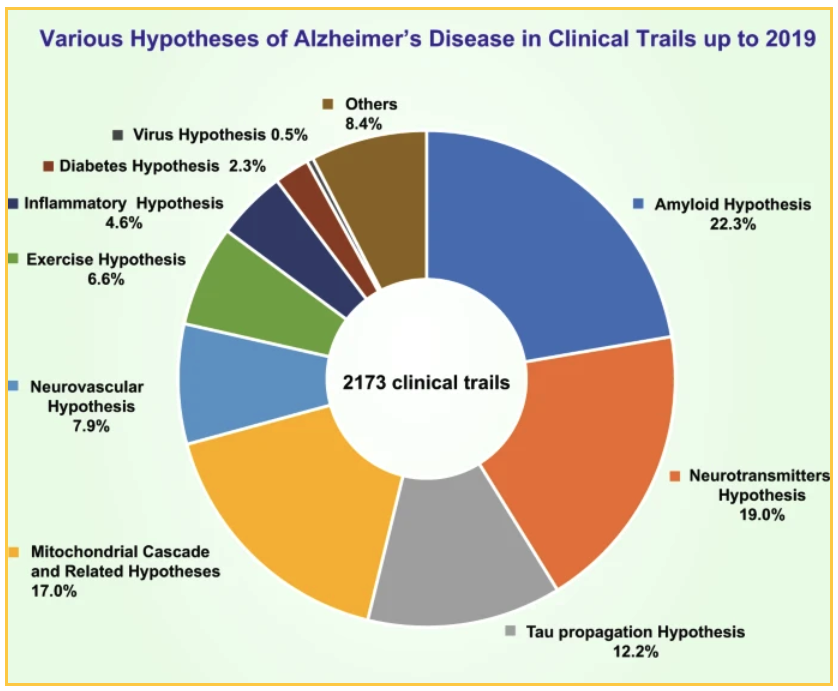
22,3% din studiile care vizează amiloid se concentreze pe diferite moduri de reducere a plăcii:
- Anticorpi generați de sistemul imunitar la beta-amiloid: "Vaccinuri active" care, atunci când sunt injectate în organism, declanșează sistemul imunitar să producă anticorpi pentru a distruge beta-amiloidul și pentru a reduce nivelurile de beta-amiloid din creier.
- Anticorpi de laborator la beta-amiloid: "Vaccinuri pasive", care sunt considerate mai eficiente și mai sigure decât încercarea de a induce producția de anticorpi în organism.
- Scăderea producției de beta-amiloid: Unele tratamente experimentale schimbă comportamentul anumitor proteine care pot preveni sau reduce producția de beta-amiloid.
- Prevenirea agregării beta-amiloide: Oamenii de știință cercetează medicamente care împiedică interacțiunile inițiale dintre beta-amiloid și celulele creierului care duc la moartea celulei creierului.
- Creșterea eliminării beta-amiloidului: Tehnici precum mobilizarea sistemului imunitar pentru a ataca beta-amiloidul sau administrarea de agenți naturali cu efecte anti-amiloide.
- Agenți naturali cu efecte anti-amiloide: Imunoglobulina intravenoasă (IVIg) obținută de la donatorii de sânge uman conține anticorpi naturali care pot reduce nivelurile de beta-amiloid.
Ce este Aduhelm (aducanumab-avwa)?
Aduhelm (aducanumab) este un anticorp anti-amiloid indicat pentru tratamentul bolii Alzheimer. Acesta este conceput pentru a elimina plăcile beta-amiloid care se formează între celulele creierului în cantități anormale la pacienții cu boala Alzheimer, ceea ce duce la moartea celulelor creierului afectate. Beta-amiloidul a fost identificat în 1984 și a fost rapid considerat principalul declanșator pentru deteriorarea celulelor creierului, în timp ce în 1986 a fost identificată proteina tau, o componentă cheie a încurcăturilor și un al doilea declanșator al deteriorării celulelor creierului.
Aduhelm a fost dezvoltat de Biogen, Inc., o companie multinațională de biotehnologie cu sediul în Massachusetts, Statele Unite ale Americii. Aduhelm se administrează sub formă de injecție lunară.
Aduhelm are o istorie lungă.
Compania elvețiană de biotehnologie Neurimmune Therapeutics AG, în colaborare cu Universitatea din Zürich, a identificat anticorpii anti-amiloidi protectori la persoanele în vârstă sănătoase și la pacienții cu demență care progresează lent și a dus la descoperirea aducanumabului, ingredientul activ din Aduhelm. La pacienții cu boală Alzheimer ușoară, un an de perfuzii intravenoase lunare de aducanumab reduce placa amiloidă, ceea ce duce la încetinirea declinului cognitiv.
Neurimmune a autorizat aducanumab pentru tratamentul bolii Alzheimer la Biogen în 2007 și lucrează în colaborare cu Biogen pentru dezvoltarea acesteia.
Cum Aduhelm muncă?
Boala Alzheimer pare a fi rezultatul acumulării neobișnuite în creier a două proteine, beta-amiloid și tau. Beta-amiloidul este o proteină care este prezentă în mod normal în creier care, în boala Alzheimer, se aglomerează în plăci de amiloid între celulele creierului - teoria amiloidului afirmă că aceste plăci dăunează și, în cele din urmă, ucid celulele creierului. Plăcile de amiloid par să se dezvolte mai devreme în boală, în timp ce tau încurcături tind să apară mai târziu în boală. O mare parte din cercetarea care a fost efectuată pentru a găsi un tratament pentru boala Alzheimer sa concentrat pe eliminarea plăcilor de amiloid.
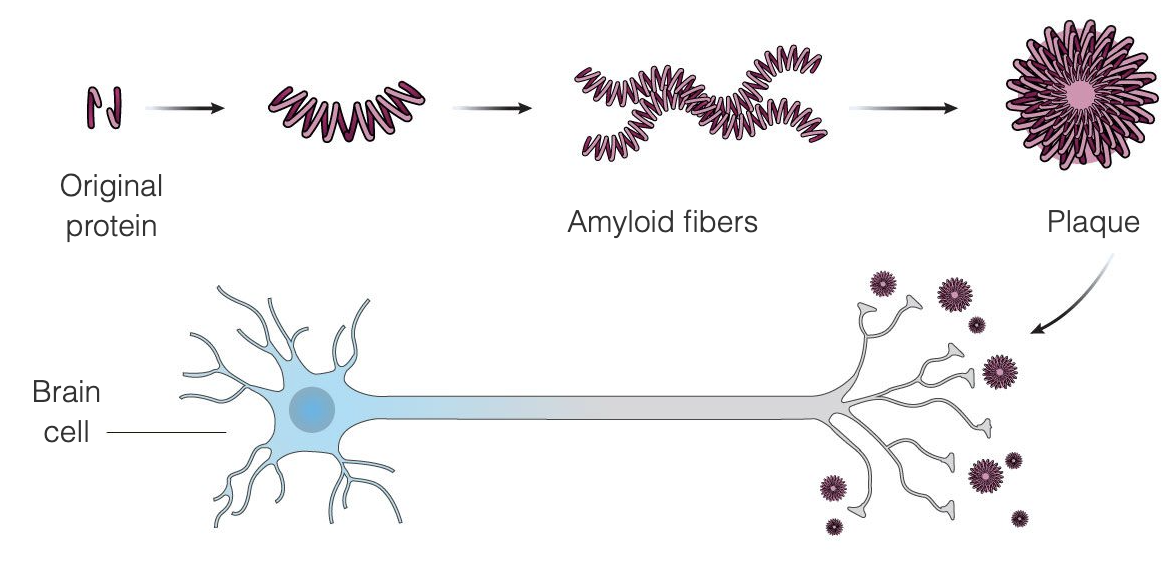
Aduhelm este conceput pentru a trata Alzheimerul în stadiile incipiente ale bolii prin legarea de plăcile amiloide, declanșând astfel sistemul imunitar să distrugă plăcile, văzându-le ca un invadator străin. Intenția este că, odată ce plăcile sunt îndepărtate, celulele creierului vor înceta să moară și funcția cognitivă va opri deteriorarea. Aduhelm utilizează acest mecanism cu scopul de a încetini progresia bolii, adresându-se în special pacienților aștești aștei ademeniți în stadiile incipiente ale bolii Alzheimer. Aduhelm nu inversează daunele care au fost deja făcute.
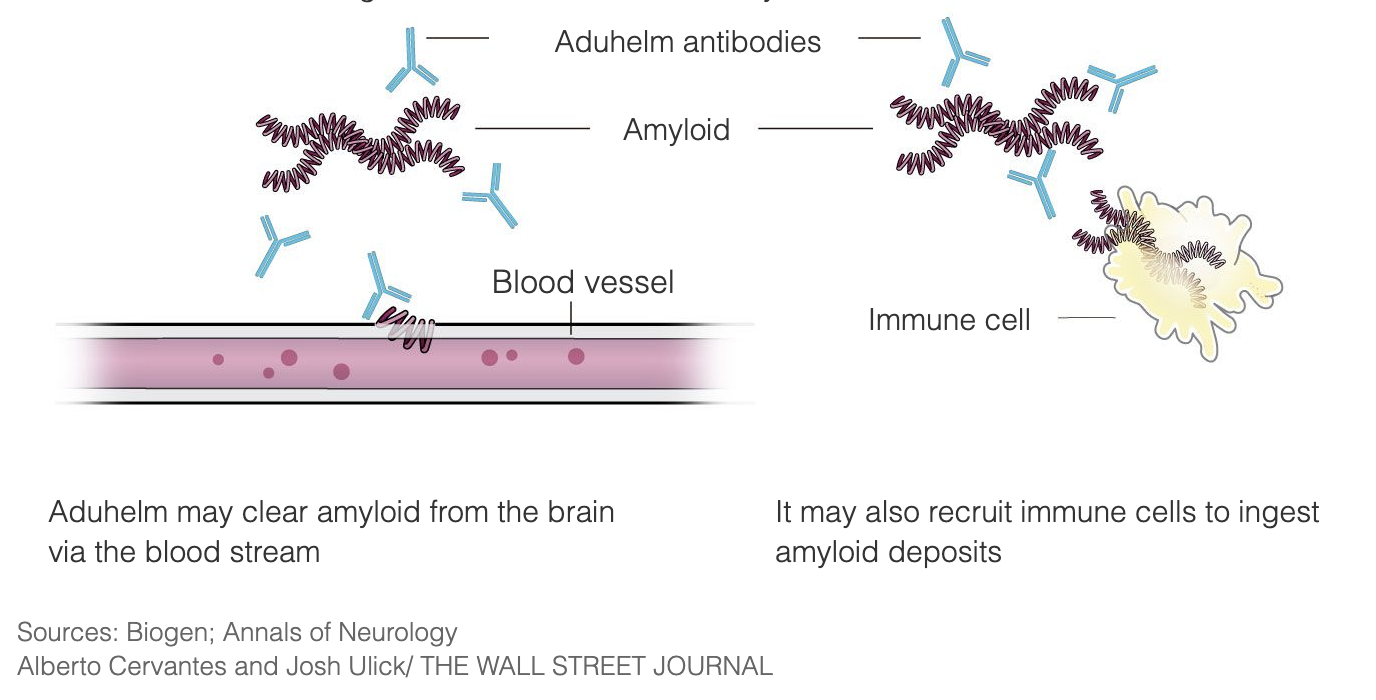
Plăcile amiloide au fost o țintă a cercetării bolii Alzheimer și a dezvoltării medicinei timp de 3 decenii și Aduhelm este unul dintre astfel de tratamente care au fost cercetate de-a lungul anilor.
"Biserica Sfântului Amiloid"
Oamenii de știință nu sunt încă de acord cu privire la ceea ce cauzează boala Alzeimer, dar au anumite teorii. Una dintre ele se numește "ipoteza amiloidă" și Aduhelm a fost dezvoltat pe baza presupunerii că această teorie este corectă.
Ipoteza amiloid afirmă că plăcile de amiloid care se formează între celulele creierului provoacă celulele să moară, ceea ce duce la declin cognitiv. Este o teorie de lungă durată, care nu a fost niciodată universal acceptat - și eșecul până în prezent a studiilor clinice care vizează plăci de amiloid au încurajat criticii săi. Unii numesc grupul de susținători ai teoriei "Biserica Sfântului Amiloid" din cauza reticenței lor care se învecinează cu refuzul de a distra teorii alternative.
Chiar și funcția normală a beta-amiloidului din creier este contestată de cercetători, deoarece nu sunt de acord cu ce rol joacă în mod natural în corpul uman sau dacă este strict un marker al bolii Alzeimer.
Un contra-argument comun la ipoteza amiloid este că plăcile se găsesc în creierele multor persoane în vârstă cu cogniție normală. Interesant, unele examinări postmortem de persoane de peste 90 de ani, cu amintiri extraordinare au relevat plăci de amiloid în creierul lor la diferite grade - unele dintre ele au avut o densitate atât de mare încât semănau cu cele mai severe cazuri de Alzheimer, și au avut, de asemenea, neuroni mult mai mult decât persoanele care au murit cu Alzheimer.
Unii cercetători cred că beta-amiloidul ar putea avea de fapt un rol protector.
George Perry, neurobiolog la Universitatea Texas din San Antonio, sugerează că "acumularea de beta-amiloid și tau este de fapt un răspuns protector la presiunile metabolice legate de vârstă din celulă", și este deosebit de util în reducerea stresului oxidativ din creier (stresul oxidativ crește odată cu vârsta, ceea ce dăunează celulelor).
Mai multe studii au investigat alte cauze potențiale ale bolii Alzheimer. Un astfel de studiu a fost condus de cercetătorii de la Icahn School of Medicine de la Muntele Sinai din New York, care au descoperit că două tulpini ale unui virus numit HHV (parte a familiei herpesvirus) se găsesc în cantități mai mari în creierele persoanelor cu boala Alzheimer. Deși nu este sigur că aceste două virusuri provoacă boala (mai probabil cauza este combinația de virus plus o anumită variantă genetică numită APOE), datele sugerează că infecția crește riscul de a dezvolta Alzheimer. și că persoanele tratate cu medicamente antivirale sunt de zece ori mai puțin susceptibile de a dezvolta Alzheimer.
În sprijinul teoriei amiloid, cu toate acestea, sunt descoperiri genetice care leagă problemele genetice legate de amiloid la dezvoltarea bolii Alzheimer cu debut precoce (la persoanele cu vârste cuprinse între 30 și 65). Sindromul Down este considerat un factor de risc, deoarece cercetătorii au descoperit că persoanele cu sindrom Down au o copie suplimentară a unui cromozom care conține codificarea genei pentru o proteină amiloidă legată de boala Alzheimer cu debut precoce.
Alte anomalii genetice pot duce la producerea de variante mai lungi de beta-amiloid care formează plăci mai ușor sau pot crește producția de beta-amiloid și pot provoca cazuri oarecum rare de boală Alzheimer cu debut precoce. Mai mulți membri ai familiei dintr-o familie pot purta aceste mutații genetice și crește riscul unui individ de a dezvolta Alzheimer cu debut precoce.
Susținătorii teoriei amiloidului sugerează că studiile anterioare care au implicat medicamente care au vizat plăcile de amiloid au fost pur și simplu eronate. De exemplu, un studiu de semagacestat, un inhibitor al producției de proteine beta-amiloide, a înrăutățit cogniția participanților la studiu; cercetătorii au observat, de asemenea, o creștere a cancerului de piele în rândul participanților. Acest lucru s-ar putea datora faptului că semagacestatul a inhibat și producția altor proteine, nu numai beta-amiloid, dintre care unele au funcții importante în corpul uman.
Explicația cea mai susținută pentru eșecul acestor studii care vizează amiloids este că medicamentele sunt medicamente dreapta, dar administrat la punctul greșit în progresia bolii Alzheimer - acestea sunt administrate prea târziu în procesul de formare a plăcilor de amiloid, un proces care începe decenii înainte de simptome apar.
Michael Murphy, neurolog la Universitatea din Kentucky, notează că ''probabil că avem deja un medicament care ar putea trata boala Alzheimer, dacă l-am da oamenilor de 50 de ani.'"
Există dezbateri semnificative cu privire la cauzele bolii Alzheimer, iar experții nu sunt încă aliniați – dar pacienții și cercetătorii au prins un nou vânt cu rezultatele într-unul dintre AduhelmStudiile clinice de fază 3.
Aduhelm în studiile clinice
Studiile clinice au loc în patru faze:
- Faza 0: Medicamentul este testat în cantități foarte mici pe mai puțin de 15 participanți pentru a se asigura că nu este dăunător și că studiul poate continua.
- Faza 1: Medicamentul este testat pe 20 până la 80 de participanți fără condiții de sănătate subiacente pentru a se asigura că nu există efecte secundare grave. Potrivit FDA, aproximativ 70% din medicamente trece la faza 2.
- Faza 2: Medicamentul este testat pe mai multe sute de participanți cu afecțiunea pentru care medicamentul este destinat pe o durată de câteva luni sau ani pentru a colecta informații despre eficacitatea și efectele secundare ale acestuia. Aproximativ 33% din medicamente trec la faza 3.
- Faza 3: Medicamentul este testat pe până la 3000 de participanți cu afecțiunea căreia îi este destinat medicamentul și poate dura câțiva ani. Medicamentul trebuie dovedit a fi sigur și eficient. 25-30% din medicamente trec la faza 4.
- Faza 4: Această fază implică mii de participanți de-a lungul mai multor ani și are loc după ce FDA a aprobat medicamentul. Scopul său este de a colecta mai multe informații despre siguranța și eficacitatea sa pe termen lung.
Aduhelm în faza 1
Biogen a efectuat mai multe studii clinice care au investigat aducanumab, începând cu trei studii de fază 1 în 2011, care au testat aducanumab la voluntari sănătoși și la pacienți cu boala Alzheimer din SUA și Japonia, lucrând cu diferite doze de aducanumab și placebo. Unii pacienți au fost înrolați timp de peste 3 ani.
În 2016, Biogen a publicat rezultatele studiului lor clinic de fază 1, în care cercetătorii au administrat perfuzii intravenoase lunare de aducanumab timp de un an participanților la studiu cu boala Alzheimer ușoară. Participanții tratați cu aducanumab au avut niveluri reduse de beta- amiloid în creier și o încetinire a declinului cognitiv, măsurată printr- un evaluare clinică oficială a demenței. În rândul participanților care au primit perfuzii cu aducanumab, cercetătorii Biogen au înregistrat, de asemenea, o reducere a efectelor secundare, ar fi ARIA (anomalii imagistice legate de amiloid, de exemplu edem cerebral sau sângerări la nivelul creierului). Biogen a constatat că aceste rezultate sunt suficient de încurajatoare pentru a trece la faza 2.
Aduhelm în faza 2
Biogen a început studiile de fază 2 la sfârșitul anului 2018 și a evaluat siguranța continuării consumului de aducanumab, pe lângă verificarea reducerii plăcilor de amiloid și încetinirea declinului cognitiv la participanții cu boală Alzheimer în stadiu incipient și simptomatic.
Aducanumab nu și- a atins obiectivul principal de a prezenta un declin cognitiv mai lent la valoarea de 12 luni, dar după 18 luni de date din studiu au fost revizuite într- o reanalizare, s- au observat efecte pozitive într- una din cele cinci doze — cea mai mare doză de aducanumab. Cea mai mare doză a fost demonstrat pentru a reduce plăcile de amiloid în creier, precum și pentru a arăta răspunsuri pozitive la cogniție.
Reacțiile adverse au fost observate, ca și în faza 1, ar fi ARIA (anomalii imagistice legate de amiloid) la aproximativ 10% din toți participanții și mai puțin de 15% la participanții cărora li s- au administrat cele mai mari doze de aducanumab.
"Rezultatele de 18 luni ale studiului BAN2401 sunt impresionante și oferă un sprijin important pentru ipoteza amiloid, a declarat Jeff Cummings, director fondator, Cleveland Clinica Lou Ruvo Centrul pentru Sanatatea Creierului, într-o declarație pentru Biospace.
Aduhelm în faza 3
După rezultatele studiului de fază 2, Biogen a efectuat două studii de fază 3, numite Engage and Emerge, care au înrolat doar sub 3300 de participanți cu boala Alzheimer relativ ușoară în America de Nord, Australia, Europa și Asia. Aducanumab a fost administrat o dată pe lună în doze mici și mari prin injectare în sânge și comparat cu rezultatele participanților cărora li s- a administrat placebo.
În martie 2019, Biogen a oprit cele două studii de fază 3, citând o analiză inutilă efectuată de un comitet independent de monitorizare a datelor, care a concluzionat că aducanumab nu pare să funcționeze conform destinației.
Decizia a afectat 3300 de participanți la studiu. Protocoalele pentru participarea la studiu au implicat vizite frecvente și extinse și au inclus prelevări de sânge, RMN, scanări PET și, uneori, robinete spinale. La șapte luni după oprirea celor două studii, Biogen a anunțat că o reanaliză a datelor suplimentare a indicat că, în doze mari, medicamentul părea să reducă declinul cognitiv.
Biogen a scris într-un comunicat de presă că datele suplimentare constau în rezultatele unui subset de pacienți din studiul de fază 3 Engage care au primit o doză mare de aducanumab și au prezentat o reducere semnificativă a deficiențelor cognitive și funcționale (memorie, orientare, limbaj), precum și beneficii pentru activitățile din viața de zi cu zi (efectuarea treburilor casnice, cumpărături, călătorii independente în afara casei). Pe baza acestor rezultate, Biogen a solicitat aprobarea de reglementare pentru aducanumab în octombrie 2019 și l-a primit la începutul lunii iunie 2021.
Deși studiile clinice de fază 3 nu au fost pe deplin concludente cu privire la beneficiile terapiei în ceea ce privește cunoașterea și funcția, FDA a concluzionat că studiile au demonstrat că aducanumab, produs sub denumirea comercială Aduhelm, poate reduce plăcile amiloide, care au stat la baza deciziei accelerate de aprobare a FDA.
Participant la studiu și reporter Phil Gutis a scris pentru platforma de știri Fiind pacient, "Am învățat printr-un studiu longitudinal PET scanare că nu mai am nici un amiloid în creierul meu. Scanarea, făcută în urmă cu aproximativ doi ani, ca parte a studiului Aging Brain Cohort de la Penn Memory Center, mi-a confirmat bănuielile crescânde că aducanumab mă ajută într-adevăr. Am început să mă simt ca și aș fi ieșit dintr-o ceață mentală constantă... Pe partea negativă, amintirile pe care le-am pierdut nu s-au întors."
Efecte secundare și contraindicații ale Aduhelm
Potrivit Ghidului de medicatieBiogen , inainte de a lua in considerare Aduhelm, pacienții ar trebui să își informeze furnizorii de servicii medicale cu privire la toate condițiile lor medicale, inclusiv în cazul în care:
- sunt gravide sau intenționează să rămână gravidă
- alăptați sau intenționați să alăptați
Pacienții ar trebui să spun furnizorilor lor de asistență medicală cu privire la orice medicamente pe care le iau, inclusiv bază de prescripție medicală și over-the-counter medicamente, vitamine, și suplimente pe bază de plante.
Conform Ghidului de medicatieBiogen , principalul efect secundar cunoscut al Aduhelm este ARIA (anomalii imagistice legate de amiloid), astfel de edem cerebral și sângerare în creier. Celelalte efecte secundare sunt:
- reacții alergice grave, sunt umflarea feței, buzelor, gurii sau limbii și urticariei
- Dureri
- Diaree
- confuzie/delir/stare mentală alterată/dezorientare
- Falls
ARIA este un efect secundar comun care nu provoacă de obicei simptome, dar poate fi grav. Acesta este cel mai frecvent văzut ca o umflare temporară a creierului, care de obicei se rezolvă pe cont propriu în timp. În același timp, îndepărtarea amiloidului din creier elimină, de asemenea, amiloidul din vasele de sânge, ceea ce poate crea mici pete de sângerare în sau pe suprafața creierului.
ARIA a fost observată la 41% dintre participanții la studiile clinice cărora li s- a administrat aducanumab, comparativ cu 10% dintre participanții cărora li s- a administrat placebo.
Deși majoritatea persoanelor cu umflare în zone ale creierului nu au simptome, aproximativ 30% dintre oameni pot avea simptome ușoare, ar fi:
- confuzie
- Dureri
- Amețeală
- modificări ale vederii
- Greaţă
Daniel Gibbs, neurolog pensionar și participant pe termen lung la Aduhelm studiile clinice, împărtășit experiența sa cu un efect secundar ARIA extrem de rare:
"Ar trebui să spun mai întâi, și aceasta este dogma care este în mare măsură adevărată, că [ARIAs] sunt de obicei benigne. Majoritatea oamenilor nu știu că o au. [ARIAs] sunt prinse doar pe scanări RMN în cazul în care nu va fi zone mici de umflare sau mici zone mici de depunere de fier de la sângerare. Dacă oamenii au simptome de la ei, acestea sunt, de obicei, ușoară. Durerea de cap este cea mai frecventă, ocazional confuzie.
Dar aproape întotdeauna, chiar și cu ARIA simptomatică, dacă opriți medicamentul, vor dispărea în câteva luni. Medicamentul poate fi repornit din nou în siguranță. Au fost foarte puține cazuri, cel puțin care au fost discutate de către producătorul de droguri Biogen, [de] catastrofale ARIA sau grave, și a mea a fost în această categorie. [...]
Am început să am o creștere a durerilor de cap. I a lua dureri de cap nu mai puțin frecvente, așa că nu cred că într-adevăr nimic din ea, dar au devenit un pic mai frecvente și, probabil, un pic mai severe, dar încă ușurat de over-the-counter [medicamente]. [...]
Apoi, cu o noapte sau două înainte de Crăciunul anului 2017, am avut cea mai mare durere de cap din viața mea, de tipul celor pe care noi, ca neurologi, le-am asocia cu hemoragia subarahnoidiană, sângerare masivă în creier. Mi-am luat tensiunea și era foarte sus și a rămas ridicată, așa că am crezut că am un atac cerebral.
Am pus-o pe soția mea să mă ducă la urgențe, și când am ajuns la spitalul nostru local, n-am putut da o istorie coerentă. [...]
Dar în câteva zile m-am descurcat un pic mai bine. Durerea mea de cap a dispărut, dar tot am avut probleme cu cititul. În următoarea lună, a devenit un pic mai rău. Rmn-ul meu de scanare de acel moment a arătat acest lucru a fost ARIA cu atât umflarea și sângerarea peste tot creierul meu. Pentru că a crescut, s-a simțit că ar trebui tratată. Am primit cinci doze de steroizi doze mari și că imediat ușurat dureri de cap și confuzie. Dar a fost nevoie de aproximativ șase luni pentru umflarea creierului meu să dispară în totalitate."
Având în vedere aceste reacții adverse potențiale rare, dar grave, furnizorii de servicii medicale ale pacienților vor trebui să efectueze scanări imagistice prin rezonanță magnetică (RMN) înainte și în timpul tratamentului cu Aduhelm pentru a verifica pentru ARIA.
Aprobarea Aduhelm (aducanumab)
Pe 7 iunie 2021, FDA a acordat aprobarea accelerată a Aduhelm (aducanumab) pentru tratamentul bolii Alzheimer.
Aprobarea accelerată este un tip de aprobare care poate fi acordat medicamentelor care prezintă un efect terapeutic pozitiv în studiile clinice, înainte de prezentarea tuturor dovezilor concludente. Acest lucru se poate aplica numai medicamentelor pentru afecțiuni grave care completează o nevoie medicală nesatisfăcută; ultimul medicament aprobat pentru tratamentul bolii Alzheimer a fost aprobat cu mai mult de 18 ani în urmă.
Aprobarea accelerată se acordă condiționat. FDA solicită producătorului, Biogen, să efectueze un nou studiu clinic. pentru a verifica beneficiul clinic al medicamentului Dacă studiul nu prezintă beneficii, FDA ar putea retrage aprobarea medicamentului. Biogen are termen până în 2029 pentru a finaliza un alt studiu clinic pentru a confirma beneficiile aducanumab pentru pacienții cu Alzheimer; experții susțin că un al treilea studiu clinic, care ar putea fi finalizat în doi ani, ar fi fost o opțiune mai bună decât așteptarea de opt ani pentru a afla dacă medicamentul funcționează, în timp ce pacienții urmează un tratament costisitor și speră la ce este mai bun.
O controversă medicală cu subtonuri financiare
Decizia FDA de a aproba aducanumab i-a nedumerit pe experții care spun că nu există suficiente dovezi că Aduhelm este un tratament eficient pentru boala Alzheimer. Mulți dintre ei, inclusiv un grup independent, au sfătuit FDA că dovezile disponibile au ridicat îndoieli semnificative că ar putea încetini declinul cognitiv și au dezbătut dacă rezultatele pozitive din doar unul dintre cele două studii de fază 3 reprezintă o bază suficientă pentru aprobarea FDA.
La scurt timp după aprobare, trei oameni de știință au demisionat în semn de protest ită din partea comitetului independent care a consiliat FDA cu privire la tratament, invocând lipsa unor dovezi convingătoare. Ei au criticat, de asemenea, decizia FDA de a aproba aducanumab pentru oricine cu Alzheimer, în ciuda studiului fiind efectuate pe stadiu incipient Alzheimer, precum și acceptarea teoriei că reducerea plăcii de amiloid ar încetini de fapt simptomele lor cognitive (în ciuda nealiniere comunitatea științifică asupra validității sale).
Decizia FDA de a aproba aducanumab în aceste condiții ar putea avea mai multe ramificații.
- Alte medicamente care vizează plăcile de amiloid, ar fi donanemab-ul lui Eli Lilly, ar putea fi aprobate mai repede decât s-a prevăzut anterior, stimulând interesul companiilor farmaceutice de a investi în medicamente pentru Alzheimer sau de a continua implicarea acestora în studiile existente.
- Decizia FDA a creat o percepție a flexibilității de reglementare care ar putea stimula alte companii biotehnologice pentru a dezvolta medicamente pentru condiții rare, o unitate care a dezumflat după un lung șir de eșecuri studiu clinic, în special în cei 18 ani între aprobările tratamente Alzheimer.
- Medicamentul este destul de costisitor, la 56.000 dolari pe an, ceea ce înseamnă că ratele de asigurări private de sănătate ar putea crește ca asigurătorii vor fi de așteptat să plătească pentru el, și va crește povara asupra contribuabililor, ca parte a Medicare (SUA naționale de asigurări de sănătate). Unii spun că ar putea fi"devastator" pentru Medicare, nu numai din cauza costurilor sale de bază, ci și pentru că tratamentul cu Aduhelm solicită pacienților să aibă diagnostice anterioare cu robinete spinale pentru a detecta amiloidul și monitorizarea constantă cu RMN (printre altele), ceea ce crește semnificativ costurile și pune presiune pe sistemele medicale.
Aprobarea este, de asemenea, văzută ca o scădere pentru Biogen, deoarece acțiunile lor au crescut cu peste 50%,în timp ce acțiunile partenerului japonez Eisai Co au urcat cu 56%. Aduhelm ar putea culege vânzări de aproximativ 10 miliarde de dolari, estimează analiștii, având în vedere că numai în SUA există 6 milioane de persoane diagnosticate cu boala Alzheimer. Medicamentul este important pentru creșterea Biogen, deoarece concurența a afectat vânzările medicamentelor lor - Tecfidera pentru scleroza multiplă (SM) și Spinraza pentru atrofia musculară spinală (SMA).
Spinraza este un alt medicament din portofoliul Biogen cu un preț ridicat, la un preț de listă de 750.000 de dolari pentru anul inițial de tratament și 375.000 de dolari pe an ulterior.
Nu toată lumea critică decizia FDA de a aproba Aduhelm
Deoarece Alzheimer este o boală progresivă, pacienții au nevoie de tratament mai devreme, mai degrabă decât mai târziu. Vestea deciziei FDA a dat multe speranțe noi, fie că tratamentul funcționează pentru ei înșiși sau lor iubit-o, sau că aceasta va impulsiona alte companii în acțiune pentru a dezvolta alte tratamente Alzheimer.
Grupurile de advocacy ale pacienților au insistat puternic pentru aprobare, deoarece există doar șase alte tratamente disponibile pentru boala debilitantă, care abordează simptomele doar pentru o chestiune de luni. În noiembrie 2020, comitetul consultativ al FDA a votat împotriva aprobării Aduhelm, ceea ce a stârnit furie și apoi acțiune în rândul Asociației Alzheimer, care apoi a militat pentru a-și exprima sprijinul pentru potențialul medicamentului și pentru a sublinia nevoia de speranță și progres.
În ianuarie 2021, FDA și grupurile de pacienți s-au întâlnit într-o sesiune de ascultare în care pacienții, îngrijitorii, clinicienii și avocații au fost în favoarea tratamentului, argumentând, printre altele, că pacienții nu își pot permite să mai aștepte un tratament.
FDA Office of New Drugs Director Peter Stein a confirmat în timpul unei conferințe de presă că opiniile pacientului a jucat un rol. El a spus FDA auzit foarte clar de la pacienți că sunt dispuși să accepte unele incertitudine pentru a avea acces la un medicament care ar putea oferi beneficii semnificative în prevenirea progresiei acestei boli, care, după știm cu toții, poate avea consecințe foarte devastatoare.
Patrizia Cavazzoni, directorul interimar al Centrului fda pentru evaluarea și cercetarea drogurilor, a declarat în timpul aceleiași conferințe de presă că "datele sprijină pacienții și îngrijitorii care au posibilitatea de a alege să utilizeze acest medicament."
"Această aprobare de droguri FDA inaugurează într-o nouă eră în tratamentul Alzheimer și de cercetare", a declarat Maria Carrillo, Ph.D, Alzheimer's Association's chief science officer. "Istoria ne-a arătat că aprobările primului medicament dintr-o nouă categorie revigorează domeniul crește investițiile în noi tratamente și încurajează o mai mare inovare."
Când va Aduhelm să fie aprobat în Europa?
Boala Alzheimer crește rapid ca una dintre crizele medicale, economice și sociale majore ale secolului - și una greu de detectat din timp, mai ales având în vedere lipsa specialiștilor din Europa care pot confirma un diagnostic. Numai în Europa, în 2018, 9,7 milioane de persoane suferă de boala Alzheimer și de alte forme de demență; până în 2030, se estimează că numărul pacienților va crește la 14 milioane, creând o nevoie disperată de tratamente eficiente.
Aduhelm nu a fost încă aprobat în afara Statelor Unite. Biogen a depus o cerere de revizuire a reglementărilor în Uniunea Europeană în octombrie 2020, precum și în Japonia, Canada, Australia și Brazilia la sfârșitul anului 2020.
Potrivit Agenției Europene pentru Medicamente (EMA), evaluarea unei cereri de autorizație de introducere pe piață pentru un nou medicament durează, de obicei, aproximativ un an, mai puțin dacă dezvoltatorul medicamentului este acordat evaluare accelerată.
În luna martie a acestui an, unitatea de producție biogen de 2 miliarde de dolari din Elveția a primit o licență de bună practică de fabricație (GMP) de la Agenția Elvețiană pentru Produse Terapeutice (Swissmedic). Biogen intenționează să solicite aprobarea FDA pentru a produce Aduhelm în unitatea elvețiană la sfârșitul anului 2021 și se așteaptă să furnizeze medicamentul la peste 1 milion de pacienți pe an.
Accesarea Aduhelm în afara Statelor Unite
Aduhelm este în prezent FDA aprobat și disponibil pentru rezidenții din Statele Unite - și există reglementări care permit medicamente pentru a fi importate în țările în care acestea nu sunt aprobate în prezent.
Pacienții cu boli care pun viața în pericol sau debilitante au dreptul de a accesa, cumpăra și importa medicamente cu ajutorul medicilor curant.
Pacienții și medicii lor pot face acest lucru pe baza reglementărilor de utilizare sau de import a pacienților , o excepție legală a reguliigenerale că un medicament poate fi accesat în mod normal numai după autorizarea / aprobarea pieței (indiferent de formularea pe care o folosim) în țara în care locuiește pacientul. Această excepție permite pacienților să aibă acces legal, etic și sigur și să obțină medicamente care nu sunt încă aprobate în țara lor.
Citiți mai multe despre "baza pacientului numit" aici (EMA).
everyone.org angajează că pacienții și medicii lor curanti pot avea acces la orice medicament disponibil în întreaga lume pentru cel mai bun tratament posibil. Operăm 100% în conformitate cu reglementările din țara dumneavoastră dacă vă aflați în afara Statelor Unite. Dacă doriți să citiți mai multe detalii, să accesați medicamentul sau doriți să contactați echipa noastră de asistență , puteți face acest lucru aici.
Cât costă Aduhelm cost?
Biogen a anunțat că Aduhelm costul la doza de întreținere (10 mg/kg) pentru un pacient mediu ar fi $56,000 pe an. Aceasta nu include testarea pe care pacienții trebuie să o facă înainte de tratament și în timpul tratamentului.
Biogen a primit critici cu privire la prețul ridicat al medicamentului pe an.
Institutul non-profit pentru revizuire clinică și economică (ICER), care analizează prețurile medicamentelor, a indicat că un preț anual corect ar varia de la 2.500 USD la 8.300 USD per pacient în fiecare an. Într-o declarație, ICER a declarat aprobarea FDA nu a reușit să protejeze pacienții, și Biogen ar putea colecta mai mult de 50 miliarde dolari pe an ", chiar în timp ce așteaptă dovezi pentru a confirma faptul că pacienții primesc beneficii reale de la tratament."
Ceo-ul Biogen, Michel Vounatsos, a răspuns criticilor afirmând că prețul medicamentului este justificat de valoarea pe care o va aduce pacienților și unei societăți mai puțin împovărate de Alzheimer și că prețul este o reflectare a "două decenii fără inovație". "Este timpul să investim în tratament", a adăugat el.
La everyone.org, nu putem influența prețul stabilit de Biogen. Suntem capabili să ajutăm pacienții să acceseze Aduhelm la următoarele prețuri:
- 1.958,58 EUR pentru un flacon de 170 mg/1,7 ml (100 mg/ml)
- €3,046.68 pentru un flacon de 300 mg/3 ml (100 mg/ml)
Faceți o anchetă aici pentru informații suplimentare.
Tratamente viitoare pentru boala Alzheimer
Un studiu publicat în mai 2021 arată că în prezent există 126 de tratamente în studiile clinicepentru boala Alzheimer. 82,5% dintre acestea vizează modificarea bolii, 10,3% sporesc cunoașterea, iar 7,1% se concentrează pe ameliorarea simptomelor neuropsihiatrice.
- Studii de fază 3: 28 tratamente (inclusiv aducanumab)
- Faza 2 studii: 74 tratamente
- Faza 1 studii: 24 tratamente
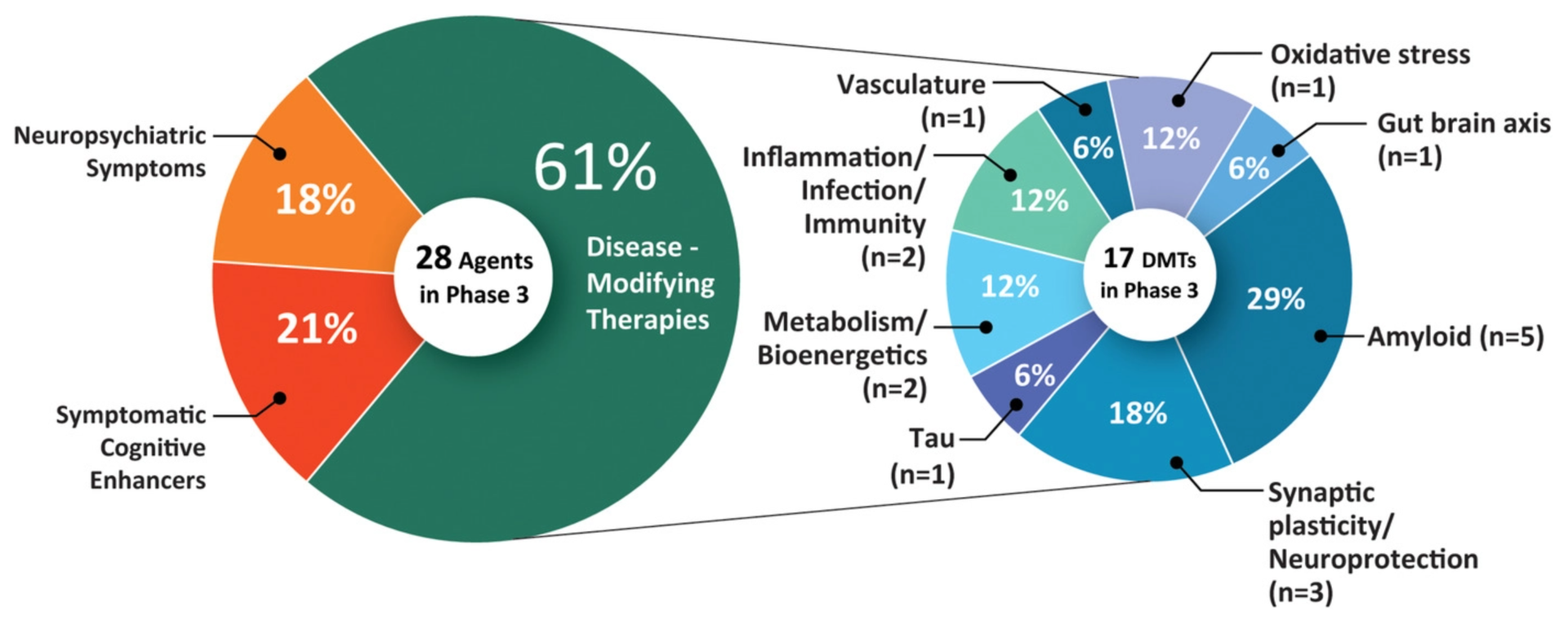
Tratamentele din studiile de fază 3 sunt cel mai probabil să fie aprobate în anul următor.
Lecanemab
Funiind într-un mod similar cu aducanumab (declanșând sistemul imunitar pentru a elimina plăcile beta-amiloide), lecanemabulanticorpilor monoclonali arată promisiunea , conform rapoartelor publicate, și sa mutat în studiile clinice de fază 3.
Gantenerumab
Gantenerumab se leagă de beta- amiloid, în special de plăcile de beta- amiloid comparativ cu beta- amiloidul individual care circulă în sânge. Se crede că dizolvă plăcile de amiloid și elimină beta-amiloidul prin stimularea fagocitozei, un proces în care o celulă ia o anumită moleculă în interiorul ei și o digeră. Studiile clinice anterioare ale gantenerumab au arătat că a redus persoanele cu plăci beta-amiloide cu forma mai frecventă de Alzheimer, care nu este cauzată direct de mutații genetice. Acesta continuă să fie studiat în două mari studii globale de fază III.
Solanezumab
Solanezumab este un anticorp care are ca scop "curățarea" beta-amiloidului din sânge și lichidul cefalorahidian, prevenind astfel formarea plăcii. Beneficiile au fost raportate la participanții care au luat parte la întreaga perioadă de trei ani și jumătate a studiilor și cu atât mai puțin la participanții care s-au alăturat mai târziu, astfel încât mai sunt încă multe de învățat despre efectele sale.
Donanemab
Donanemab pare a fi un alt medicament promițătoare viitoare pentru tratamentul Alzheimer. Acesta este testat de Eli Lilly and Company, care intenționează să înscrie 1500 de participanți într-un studiu amplu pentru a confirma rezultatele studiului său mai mic; acest studiu anterior a durat 76 de săptămâni și a inclus 257 de pacienți și, potrivit rapoartelor, a arătat că donanemab a încetinit semnificativ progresul bolii Alzheimer.
Alţii
Saracatinib este un compus experimental care acționează ca un inhibitor al unei proteine numite Fyn kinaza care ajută la formarea plăcilor beta-amiloide. Un studiu efectuat pe șoareci a arătat că saracatinib, prin inhibarea Fyn kinase, a fost eficient în inversarea pierderii memoriei la șoareci. Inhibarea Fyn kinase poate preveni sau întârzia progresia bolii.
Cercetătorii de la Institutul Salk pentru Studii Biologice din California studiază o substanță chimică numită fisetină și au dezvoltat o versiune de fisetină numită CMS121, pe care au găsit-o eficientă în încetinirea pierderii celulelor creierului. Sunt necesare mai multe cercetări înainte ca un medicament să fie gata pentru aprobare.
Cu referire la Aduhelm"Aprobarea recentă, Maria Carrillo, Chief Science Officer pentru pacient-advocacy grup Alzheimer's Association din Chicago, SUA, a declarat într-o declarație pentru Natura: "Suntem plini de speranță, și acesta este începutul - atât pentru acest medicament și pentru tratamente mai bune pentru Alzheimer."
"Totce suntem cu adevărat sunt gândurile și creierul nostru." – Sandy, fost dentist și profesor asistent și pacient cu Alzheimer.
În everyone.org, suntem convinși că știința mișcă rasa umană înainte și îmbunătățește sau chiar salvează vieți. Boala Alzheimer pune în pericol calitatea vieții multora. Încurajăm oamenii de știință dedicați găsirii unei (părți a) soluției să persevereze și așteptăm cu nerăbdare ca tratamentele în curs de dezvoltare care prezintă rezultate promițătoare să fie aprobate și să devină accesibile pentru pacienții cu Alzheimer din întreaga lume în următorii 3 ani.